4B Liceo Scientifico - FISICA a.s. 2020-2021
↓bottom↓
"Una legge fisica è una regolarità della natura esprimibile in forma matematica" (Richard Feynman, USA 1918-1988)
 DaD - Didattica a Distanza 2020-2021
DaD - Didattica a Distanza 2020-2021
GOOGLE CLASSROOM: codice corso 4B FISICA: 3pqiux2
(utilizzare le credenziali di Google Suite già fornite dal liceo - tutorial come iscriversi)
 profili GeoGebra 4B (link)
profili GeoGebra 4B (link)

 elenco di possibili domande di teoria (pdf)
elenco di possibili domande di teoria (pdf) 
 programma FISICA 2020-2021 (pdf)
programma FISICA 2020-2021 (pdf) 
 Calcolatrici ammesse esame di stato (nota MIUR - circolare 105)
Calcolatrici ammesse esame di stato (nota MIUR - circolare 105)
materiali utili per il ripasso:
 Unità di misura nel S.I. (link)
Unità di misura nel S.I. (link)
 rappresentazione cronologica dell' ECUMENE (link)
rappresentazione cronologica dell' ECUMENE (link)
 Cronologia 1: Atomi e molecole (pdf)
Cronologia 1: Atomi e molecole (pdf)
 Cronologia 2:"sia fatta la luce", i modelli corpuscolare ed ondulatorio (pdf)
Cronologia 2:"sia fatta la luce", i modelli corpuscolare ed ondulatorio (pdf)
 Cronologia 3: Oltre l'atomo: lo spazio interno (pdf)
Cronologia 3: Oltre l'atomo: lo spazio interno (pdf)
 Ripasso termodinamica 3 anno
Ripasso termodinamica 3 anno
↓bottom↓
↑top↑
 DaD - Didattica a Distanza 2020-2021
DaD - Didattica a Distanza 2020-2021
 VideoEsperimento n.1 - calcolo della lunghezza d'onda di un suono con PhyPhox (thanks to An.Ma.)
VideoEsperimento n.1 - calcolo della lunghezza d'onda di un suono con PhyPhox (thanks to An.Ma.)
 VideoEsperimento n2: misura le frequenze dei battimenti con lo smartphone (thanks to Gr.Mu.)
VideoEsperimento n2: misura le frequenze dei battimenti con lo smartphone (thanks to Gr.Mu.)
 VideoEsperimento n3: il calcolo della velocità del suono con il cronometro acustico di (thanks to Be. e Vi. Bo.)
VideoEsperimento n3: il calcolo della velocità del suono con il cronometro acustico di (thanks to Be. e Vi. Bo.)
- - -
 VideoEsercizio n.73 pag.75: l'ECODOPPLER (thanks to Ca.Bo.)
VideoEsercizio n.73 pag.75: l'ECODOPPLER (thanks to Ca.Bo.)
- - -
 VideoInterrogazione n.1 - la temperatura (thanks to So.Ta.)
VideoInterrogazione n.1 - la temperatura (thanks to So.Ta.)
 VideoInterrogazione n.1 - la temperatura (thanks to So.Ta.)
VideoInterrogazione n.1 - la temperatura (thanks to So.Ta.)
 VideoInterrogazione n4 - Primo Principio della Termodinamica (thanks to Fr.Ce.)
VideoInterrogazione n4 - Primo Principio della Termodinamica (thanks to Fr.Ce.)
 VideoInterrogazione n.6 - l'ENTROPIA (thanks to Fa.Li.)
VideoInterrogazione n.6 - l'ENTROPIA (thanks to Fa.Li.)
 VideoInterrogazione n7 - onde meccaniche (thanks to Mi.Ac.)
VideoInterrogazione n7 - onde meccaniche (thanks to Mi.Ac.)
 VideoInterrogazione n9 - Effetto Doppler 1 (thanks to Gi.Le.)
VideoInterrogazione n9 - Effetto Doppler 1 (thanks to Gi.Le.)
 VideoInterrogazione n10 - Effetto Doppler 2 (thanks to Fr.Ta.)
VideoInterrogazione n10 - Effetto Doppler 2 (thanks to Fr.Ta.)
 VideoInterrogazione n11 - Principio di sovrapposizione, interferenza e diffrazione (thanks to Ia.Ba.)
VideoInterrogazione n11 - Principio di sovrapposizione, interferenza e diffrazione (thanks to Ia.Ba.)
 VideoInterrogazione n12 - Onde Stazionarie (thanks to To.Te.)
VideoInterrogazione n12 - Onde Stazionarie (thanks to To.Te.)
 VideoInterrogazione n13 - Battimenti (thanks to Ag.Vi.)
VideoInterrogazione n13 - Battimenti (thanks to Ag.Vi.)
 Lorenzo Baglioni - I Principi della Termodinamica feat. I Supplenti Italiani
Lorenzo Baglioni - I Principi della Termodinamica feat. I Supplenti Italiani
il SECONDO PRINCIPIO della TERMODINAMICA (cap.8)
PREMESSA 1: SE L'ENERGIA SI CONSERVA (PRIMO PRINCIPIO DELLA TERMODINAMICA) DOVE SAREBBE IL "PROBLEMA ENERGETICO"?
PREMESSA 2:"ENERGIA" dal greco: "capacità di agire". Tradotto in fisica: "capacità di compiere LAVORO"
- una MACCHINA TERMICA è un dispositivo che trasforma l'energia interna dei corpi in lavoro meccanico mediante trasformazioni cicliche di un sistema termodinamico
- il RENDIMENTO di una macchina termica è il rapporto tra lavoro compiuto L e calore assorbito QC misurati durante un ciclo

enunciato del secondo principio della Termodinamica:
 |
Enunciato di Lord KELVIN (William Thomson, UK, 1824-1907):
“non è possibile realizzare una trasformazione il cui unico risultato sia quello di convertire in lavoro del calore sottratto a un'unica sorgente a temperatura uniforme”(ad es. dal mare)ossia: per trasformare calore in lavoro occorrono almeno due corpi a temperatura differente |
 |
enunciato di CLAUSIUS (Rudolf, DE, 1822-1888)
“non è possibile realizzare una trasformazione il cui unico risultato sia il passaggio di calore da un corpo più freddo a uno più caldo senza l’apporto di lavoro esterno” |
| si potrebbe equivalentemente enunciare: "in un sitema energeticamente isolato tutte le differenze di temperatura tendono ad annullarsi spontaneamente" | |
oppure: "in un sitema energeticamente isolato a temperatura uniforme non si possono spontaneamente creare differenze di potenziale termico tra diverse regioni" di conseguenza è necessario consumare energia per raffredare un ambiente come l'interno di un frigorifero o launa stanza con un climatizzatore |
|
conseguenze del secondo principio della Termodinamica: 1. è impossibile far passare calore da un corpo più freddo a uno più caldo senza compiere lavoro 2. è impossibile trasformare tutto il calore in lavoro 3. è impossibile costruire una macchina termica con rendimento η=1
infatti la macchina deve necessariamente operare tra due termostati a uno dei quali cedere il calore Qf che non può essere nullo (in queste notazioni f sta per freddo e c sta per caldo) di fatto le macchine termiche reali difficilmente raggiungono rendimenti superiori al 50%, è necessario quindi individuare le condizioni che assicurano il maggior rendimento possibile, per far questo si definisce: una trasformazione è detta reversibile se, a partire dallo stato finale, è possibile riportare sia il sistema sia l'ambiente con cui interagisce ai rispettivi stati iniziali in generale una trasformazione è reversibile se: N.B. le trasformazioni reali sono tutte irreversibili (ad esempio...) |
|
 |
Teorema di CARNOT (Sadi, Fr, 1796-1832)
“tutte le macchine termiche REVERSIBILI, operanti tra le temperature Tc e Tf, hanno lo stesso rendimento ηrev e nessuna macchina reale (=irreversibile), operante fra le stesse temperature può avere un rendimento ηirrev maggiore:”ηrev ≥ ηirrev
conseguenze del teorema di Carnot: Il rendimento di una macchina di Carnot (detta anche macchina ideale o macchina reversibile) che opera tra le temperature Tc e Tf è dato da (dove le temperature sono espresse in gradi Kelvin):
|
4. è impossibile raggiungere lo zero assoluto mediante un numero finito di trasformazioni termodinamiche (è anche detto Terzo principio della Termodinamica)Infatti se, per assurdo, una macchina termica potesse operare tra una sorgente TC e Tf=0K si potrebbe avere una macchina con rendimento pari ad 1 tecnicamente ci si è avvicinati sempre di più allo zero assoluto: |
|
5. è impossibile il moto perpetuo infatti il moto perpetuo di prima specie è in aperta violazione del primo principio della Termodinamica
|
|
avendo osservato che: nel 1865 Clausius ritenne di introdurre una nuova FUNZIONE di STATO: l'ENTROPIA "ENTROPIA" dal greco: "TRASFORMAZIONE INTERNA" scrive Clausius: “ho voluto intenzionalmente adottare il termine entropia per rimanere il più vicino possibile alla parola energia, in quanto le due grandezze … sono così affini in senso fisico che anche nella definizione questo accostamento pare opportuno” secondo Clausius il comportamento asimmetrico del calore rappresentava due diversi tipi di cambiamento: uno era un cambiamento di temperatura (energia termica che passava dal caldo al freddo), l’altro era un cambiamento di energia (energia meccanica che si trasformava in energia termica per attrito) e concluse che queste variazioni erano due aspetti dello stesso fenomeno: variazioni di ENTROPIA. Dunque per le applicazioni è necessario calcolare le variazioni di ENTROPIA di un sistema, (l’entropia non è misurabile direttamente) così definite: 
[l'ENTROPIA si misura in J/K] Da questa definizione l’ENTROPIA dipende non solo dagli scambi di energia, ma anche dalla Temperatura.
Clausius sosteneva che tutte le variazioni di carattere naturale (variazioni di energia e temperatura che si verificano spontaneamente in natura come ad esempio il fluire di calore dal corpo più caldo al più freddo o la trasformazione di energia in calore per attrito) sarebbero state considerate variazioni positive (=entropia in aumento); mentre tutte le variazioni innaturali (tutte le variazioni di energia e temperatura che si verificano quando la natura è sollecitata da una macchina) sarebbero state considerate variazioni entropiche negative. Egli giunse alla conclusione che tutti gli scambi di entropia positiva e negativa che si verificano nella totalità delle macchine esistenti nell’universo avevano sempre l’effetto di aumentare l’entropia. Il nostro universo è popolato da macchine imperfette, fossero queste animate e minuscole come le cellule del corpo umano o inanimate e gigantesche come le galassie. Nel nostro universo l’energia totale si conserva, ma l’entropia aumenta
dunque tutto l’universo invecchierà e morirà una volta che tutti i suoi fenomeni naturali irreversibili si saranno completamente esauriti, quando cioè non ci saranno più due sorgenti di calore a temperature differenti, ma tutto l’universo si troverà alla stessa temperatura e le trasformazioni spontanee non saranno più possibili (cfr.enunciato di KELVIN) - Il 2° principio diventa dunque una formulazione del principio di NON conservazione dell’ENTROPIA la degradazione dell'energia, o l'aumento di Entropia, è una conseguenza statisticamente prevedibile dei movimenti e delle collisioni che avvengono a caso tra le molecole. Si considerino ad esempio due contenitori di un gas isolati a diversa temperatura, quando verranno messi a contatto le molecole calde (le più veloci) e le molecole fredde (meno veloci) passeranno a caso da un ambiente all'altro (o meglio scambieranno a caso le loro energie cinetiche durante gli urti in modalità simili a quelle descritte nel moto Browniano) e con il passare del tempo ciò renderà nulla la differenza di temperatura iniziale tra i due scomparti. L'aumento di Entropia che ne consegue è legato ad un aumento di disordine: le molecole veloci e quelle lente inizialmente separate si mescoleranno e l'energia totale del sistema si ripartirà statisticamente in conseguenza delle collisioni che si verificheranno e i due scomparti inizialmente distinguibile per la temperatura diventeranno equivalenti. Prima del mescolamento il sistema avrebbe potuto compiere un lavoro in virtù della differenza di temperatura tra i due scomparti, ma una volta raggiunto l'equilibrio termico nessun lavoro potrà più prodursi.
6. è impossibile diminuire l'ENTROPIA di un sistema isolato (senza compiere lavoro dall'esterno) 
in un sistema isolato, lo stato di entropia massima è lo stato di equilibrio stabile |
|
 |
Boltzmann (Ludwig, AU, 1844-1906) suggerì che l’entropia possa anche essere letta come misura del disordine di un sistema e stabilì che: “L’Entropia di uno stato macroscopico è proporzionale alla probabilità termodinamica di quello stato:”
approfondimento: il "diavoletto" di Maxwell
l'irreversibilità di una trasformazione termodinamica è connessa all'aumento di entropia del sistema, come anche l'irreversibilità dei processi naturali è legata all'aumento del disordine che qualunque sistema manifesta durante la sua evoluzione. Osservando l'immagine seguente nessuno si aspetta che la disposizione ordinata per colore delle biglie sia stata ottenuta scuotendo la scatola a partire dalla disposizione disordinata
|
| 7. è impossibile tornare indietro nel tempo
Tutte queste scoperte significavano per Clausius, che l’universo, essendo un sistema isolato, stava diventando più caotico e che quindi, tempo prima, dovesse essere stato molto più ordinato, insomma come se Qualcosa o Qualcuno avesse costruito un meccanismo e lo avesse caricato come un orologio a molla che ora pian piano stava perdendo la sua carica ed era destinato a fermarsi... CLAUSIUS osservò inoltre che: “l’energia dell’universo è costante (l’intero universo può essere considerato un sistema isolato e l’energia in esso contenuta è da sempre la stessa, in accordo con il primo pincipio), ma l’entropia è in aumento” (quindi gli scambi di energia, da cui dipende la vita, non saranno possibili per sempre e dato che la vita esiste ancora si può concludere che l’universo non esiste da infinito tempo…) 8. è impossibile che l'universo esista da infinito tempo |
|
| 9. ............................ | |
| 10. ........................... |
non è semplice spiegare l'entropia con poche parole, alcuno hanno provato a farlo sul web:
 cosa è l'entropia? video entropia la fisica che ci piace
cosa è l'entropia? video entropia la fisica che ci piace
 Che cos'è l'entropia? #AstroCaffè
Che cos'è l'entropia? #AstroCaffè
 L'ENTROPIA spiegata lanciando castagne
L'ENTROPIA spiegata lanciando castagne
 Cos'è l'entropia? Amedeo Balbi
Cos'è l'entropia? Amedeo Balbi
 Un Meccanismo Perverso - Entropia#01 - CURIUSS
Un Meccanismo Perverso - Entropia#01 - CURIUSS
- - -
↓bottom↓
↑top↑
OSCILLAZIONI e ONDE MECCANICHE (cap.13 - vol.2)
 ripasso moti fondamentali (PDF)
ripasso moti fondamentali (PDF)
- - -
- si dice MOTO ARMONICO il moto di un corpo la cui accelerazione è direttamente proporzionale allo spostamento dalla posizione di equilibrio e ha verso opposto
 1. Scheda di lavoro con GeoGebra sul MOTO ARMONICO (pdf)
1. Scheda di lavoro con GeoGebra sul MOTO ARMONICO (pdf)
 VIDEO TUTORIAL della costruzione sul Moto Armonico (thanks to Ma.Fa.)
VIDEO TUTORIAL della costruzione sul Moto Armonico (thanks to Ma.Fa.)
Moto Armonico e moto circolare le componenti
- - -
 2. Scheda di lavoro con GeoGebra sulla legge oraria del MOTO ARMONICO (pdf)
2. Scheda di lavoro con GeoGebra sulla legge oraria del MOTO ARMONICO (pdf)
- - -
onde trasversali e onde longitudinali
- - -
 3. Schede lavoro con GeoGebra rappresentazione matematica onde armoniche 2D e 3D (pdf)
3. Schede lavoro con GeoGebra rappresentazione matematica onde armoniche 2D e 3D (pdf)
 VIDEO TUTORIAL della costruzione di onde armoniche 2D (thanks to El.Ba.)
VIDEO TUTORIAL della costruzione di onde armoniche 2D (thanks to El.Ba.)
 VIDEO TUTORIAL della costruzione di onde armoniche 3D (thanks to El.Ba.)
VIDEO TUTORIAL della costruzione di onde armoniche 3D (thanks to El.Ba.)
- - -
onde su una corda:
la velocità di propagazione v di un'onda su una corda con densità lineare µ=m/l si misura in [kg/m] e sottoposta ad una tensione T (è una forza in [N] è:

- - -
Principio di sovrapposizione:
"nella regione in cui si sovrappongono due o più onde, la perturbazione totale è la SOMMA delle ampiezze delle perturbazioni che ciascuna di esse produrrebbe da sola"
 esempio Principio di sovrapposizione con GeoGebra
esempio Principio di sovrapposizione con GeoGebra
 esempio Principio di sovrapposizione con GeoGebra 3D
esempio Principio di sovrapposizione con GeoGebra 3D
la riflessione di una onda (e onde stazionarie):
- - -
ONDE STAZIONARIE :
"fenomeno di interferenza di due onde trasversali della stessa frequenza, in opposizione di fase, che si propagano con la stessa velocità tra due estremi fissi":
 onde stazionarie (link geogebra)
onde stazionarie (link geogebra)

le lunghezze d'onda dei modi normali sulla corda di lunghezza L, sono:

essendo la lunghezza d'onda, la velocità di propagazione delle onde sulle corde e la frequenza legate dalla relazione v=λ·f
le frequenze d'onda dei modi normali sulla corda di lunghezza L, sono:
- - -
breve ripasso:
- - -
- - -
la risonanza meccanica: il crollo del ponte di Tacoma
- - -
↓bottom↓
↑top↑
Il SUONO (cap.14 - vol.2)
 on line tone generator (link)
on line tone generator (link)
onde sonore:
frequenza udibili:
come vedere le onde sonore:
suono puro: è un onda sonora armonica caratterizata da una sola frequanza
il Timbro di un suono è dovuto alla sovrapposizione di più armoniche
riconosciamo la stessa nota suonata da strumenti diversi perchè ha sempre la stessa altezza che corrisponde alla frequanza fondamentale
riconosciamo la "voce" dei vari strumenti perché l'onda sonora di ciascuno di essi è caratterizzata da un particolare insieme di frequenze
riconosciamo la stessa nota suonata da strumenti diversi perchè ha sempre la stessa altezza che corrisponde alla frequanza fondamentale
riconosciamo la "voce" dei vari strumenti perché l'onda sonora di ciascuno di essi è caratterizzata da un particolare insieme di frequenze
 un esempio di somma di onde sinusoidali
un esempio di somma di onde sinusoidali
 un esempio di SERIE di FOURIER.
un esempio di SERIE di FOURIER.
 la legge dell'inverso del quadrato (link)
la legge dell'inverso del quadrato (link)
 esercizio n.17 pag.69 -
esercizio n.17 pag.69 -  protocollo di costruzione
protocollo di costruzione
 costruire un'onda per riprodurre un SUONO puro -
costruire un'onda per riprodurre un SUONO puro -  protocollo di costruzione
protocollo di costruzione
- - -
il fenomento dei Battimenti:
"variazioni periodiche dell'intensità del suono dovute all'interferenza di due onde sonore con frequenze leggermente diverse" (link geogebra)
- - -
diffrazione di una onda attraverso una fenditura: il suono si diffonde verso l'esterno e si incurva (=diffrange) a causa degli effetti di interferenza tra le onde sonore prodotte, l'intensità del suono è per lo più confinata all'interno di un angolo e dipende dalla lunghezza d'onda e dalla dimensione della fenditura
un'onda subisce una diffrazione consistente quando incide su un ostacolo con dimensioni uguali o minori della sua lunghezza d'onda
i fenomeni di DIFFRAZIONE posso essere spiegati mediante il Principio di Huygens:
"ogni punto di un fronte d'onda si comporta come sorgente di onde sferiche che si propagano con la stessa velocità dell'onda"
OSSERVAZIONE: Interferenza e Diffrazione sono fenomeni strattemente connessi e sono trattati in modo distinto per ragioni storiche, entrabi i fenomeni hanno origine dalla sovrapposizione di fronti d'onda emessi da sorgenti coerenti
- - -
Effetto Doppler (C.Doppler, Au, 1803-1853)
boom supersonico
- - -
 Simulazioni di fenomeni sulle onde (link)
Simulazioni di fenomeni sulle onde (link)
 VIDEO il suono: onde stazionarie, battimenti, effetto Doppler, muro del suono e theremin (youtube)
VIDEO il suono: onde stazionarie, battimenti, effetto Doppler, muro del suono e theremin (youtube)
 VIDEO le onde in un minuto (youtube)
VIDEO le onde in un minuto (youtube)
 Appunti e formulario sulle onde (pdf)
Appunti e formulario sulle onde (pdf)
- - - - - - - - - -

 Esercitazione sulle onde(pdf)
Esercitazione sulle onde(pdf)
 Esercizio n.1 - esercizio n.2 - esercizio n.3 - esercizio n.4
Esercizio n.1 - esercizio n.2 - esercizio n.3 - esercizio n.4
- - - - - - - - - -

 Test online sulle onde (pdf)
Test online sulle onde (pdf)
 Soluzione test on line sulle onde (pdf)
Soluzione test on line sulle onde (pdf)
- - - - - - - - - -

 ZANICHELLI TEST allenamento su Oscillazioni e onde meccaniche Cap.13 (link)
ZANICHELLI TEST allenamento su Oscillazioni e onde meccaniche Cap.13 (link)

 ZANICHELLI TEST allenamento sul Suono Cap.14 (link)
ZANICHELLI TEST allenamento sul Suono Cap.14 (link)
- - - - - - - - - -
↓bottom↓
↑top↑
 VideoEsperimento n1: misura la lunghezza d'onda di un suono e la velocità del suono in aria con lo Smartphone
VideoEsperimento n1: misura la lunghezza d'onda di un suono e la velocità del suono in aria con lo Smartphone 
 VideoEsperimento n2: misura le frequenze dei battimenti con lo smartphone
VideoEsperimento n2: misura le frequenze dei battimenti con lo smartphone 
 Videoesperimento n3: il calcolo della velocità del suono con il cronometro acustico di
Videoesperimento n3: il calcolo della velocità del suono con il cronometro acustico di
- - - VideoEsercizi - - -
gira un breve video in cui mostri come risolvere l'esercizio e facendo riferimenti tecnici all'Ecografo o all'ecodoppler
- VideoEsercizio n.71 pag.75 l'ECOGRAFO
- VideoEsercizio n.73 pag.75-76 l'ECODOPPLER
↓bottom↓
↑top↑
CAPITOLO 15 - OTTICA FISICA
Richiami di ottica geometrica:
1. La RIFLESSIONE e la RIFRAZIONE DELLA LUCE
- - -
 scheda di lavoro sulla legge della riflessione e della rifrazione (pdf)
scheda di lavoro sulla legge della riflessione e della rifrazione (pdf)
 Legge della RIFLESSIONE (link)
Legge della RIFLESSIONE (link)
 Legge empirica della RIFRAZIONE (link)
Legge empirica della RIFRAZIONE (link)
- - -
Dall'ottica Geometrica all'ottica fisica:

 Cronologia 2:"sia fatta la luce", cronologia dei modelli corpuscolare ed ondulatorio (pdf)
Cronologia 2:"sia fatta la luce", cronologia dei modelli corpuscolare ed ondulatorio (pdf)
- - -
Il CALCOLO della VELOCITA' della LUCE:
1. La velocità della luce, le parole di Galileo (1632)
da "Discorsi e dimostrazioni matematiche intorno a due nuove scienze" leggi a pag.27
- - -
2. La velocità della luce, l'esperienza di Römer (1676): scheda di lavoro con Stellarium (pdf)
 l'esperienza di Römer spiegata da lui stesso (università Paris-sud)
l'esperienza di Römer spiegata da lui stesso (università Paris-sud)
- - -
3. La velocità della luce, l'esperimento di Fizeau 1849 (link)
 la machine de Fizeau - (quella originale, il video migliore, ma in francese)
la machine de Fizeau - (quella originale, il video migliore, ma in francese)
 la macchina di Fizeau ricostruita a Tor Vergata
la macchina di Fizeau ricostruita a Tor Vergata
 i calcoli della velocità della luce con la macchina di Fizeau (pdf)
i calcoli della velocità della luce con la macchina di Fizeau (pdf)
- - -
4. La ricerca della precisione: Leon Focault 1850
 la machine de Focault - (quella originale, il video migliore, ma in francese)
la machine de Focault - (quella originale, il video migliore, ma in francese)
- - -
- - -
- - -
 Appunti: l' Experimentum Crucis di Newton (pdf)
Appunti: l' Experimentum Crucis di Newton (pdf) 
 i colori RGB (GeoGebra)
i colori RGB (GeoGebra)
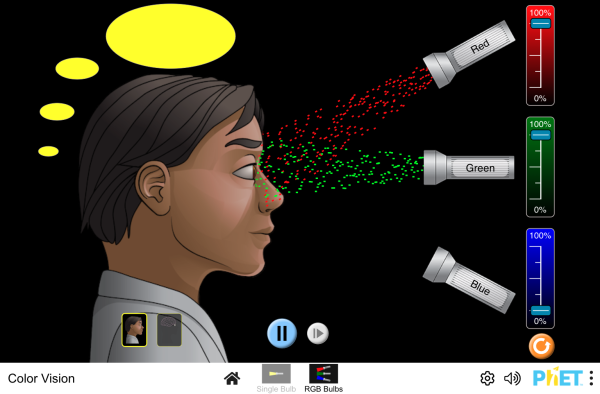
la percezione umana del colore:
- - -
la doppia rifrazione con un cristallo di spato d'Islanda:
 la bussola dei vichinghi (doc superquark youtube)
la bussola dei vichinghi (doc superquark youtube)
- - -
- - -
 Appunti sull'interferometro di Young (pdf)
Appunti sull'interferometro di Young (pdf) 
 l'esperimento di T.Young (UK, 1773-1829) per la misura della lunghezza d'onda della luce (GeoGebra)
l'esperimento di T.Young (UK, 1773-1829) per la misura della lunghezza d'onda della luce (GeoGebra) 
 (GeoGebra)
(GeoGebra) 
Figure di interferenza o di diffrazione (=insieme di frange luminose e scure raccolte su uno schermo, è un fenomeno associato alla deviazione della traiettoria di propagazione delle onde) ottenute in classe con un laser ed una singola fenditura:
- - -
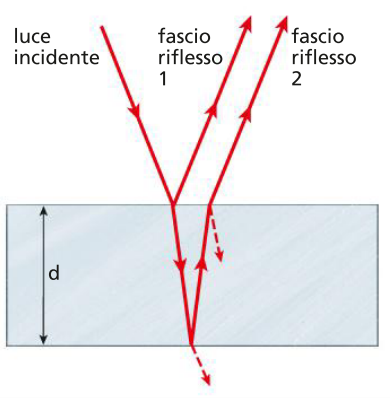
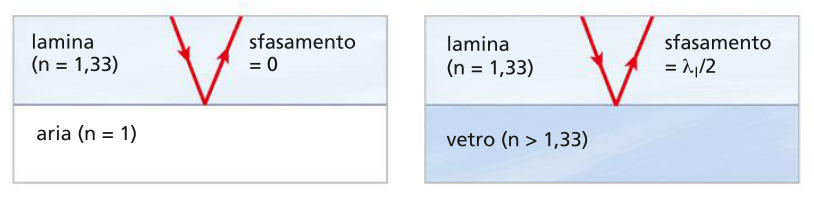
interferenza su lamina sottile
- - -
- - -

 scheda di lavoro sulle radiazioni elettromagnetiche (pdf)
scheda di lavoro sulle radiazioni elettromagnetiche (pdf)
- - -

 Scheda di lavoro con i reticoli di diffrazione (pdf)
Scheda di lavoro con i reticoli di diffrazione (pdf) 
Principio di Huygens: "ogni punto di un fronte d'onda si comporta come sorgente di onde sferiche che si propagano con la stessa velocità dell'onda"
Figure di diffrazione ottenute in classe con un laser ed un reticolo di diffrazione
(= lastra trasparente su cui sono praticate numerose fenditure parallele ed equispaziate) :
separazione dei colori con un reticolo di diffrazione 1000linee/mm (posto direttamente sulla fotocamera):
reticolo 1000 linee per mm:
 |
 |
 |
 |
 |
 |
reticolo 500 linee per mm:
 |
 |
 |
 |
 |
 |
- - -
La "macchia luminosa" di Poisson (Fr,1781-1840) - Fresnel (Fr,1788-1827) - Arago (Fr,1786-1853):
- - -
 schema riassuntivo: onde sonore e onde luminose (pdf)
schema riassuntivo: onde sonore e onde luminose (pdf)
- - -

 ESERCITAZIONE verifica sulla OTTICA FISICA (Cap.15) - soluzioni (pdf)
ESERCITAZIONE verifica sulla OTTICA FISICA (Cap.15) - soluzioni (pdf)
 svolgimento es. n.1 (pdf) -
svolgimento es. n.1 (pdf) -  svolgimento n.2 (pdf) -
svolgimento n.2 (pdf) -  svolgimento n.3 (pdf) -
svolgimento n.3 (pdf) -  svolgimento n.4 (pdf)
svolgimento n.4 (pdf)
- - -
↓bottom↓
↑top↑
CAPITOLO 16 - CARICHE ELETTRICHE E CAMPI ELETTRICI
 elettricità statica (link)
elettricità statica (link)
 Carica elettrica e forza di Coulomb:
Carica elettrica e forza di Coulomb:
 la Legge di Coulomb:
la Legge di Coulomb:
ripasso geometria: 
- - -
il principio di sovrapposizione: un esercizio svolto:
 ordini di grandezza: massa (link)
ordini di grandezza: massa (link)
 richiami utili: il numero di Avogadro (pdf)
richiami utili: il numero di Avogadro (pdf)
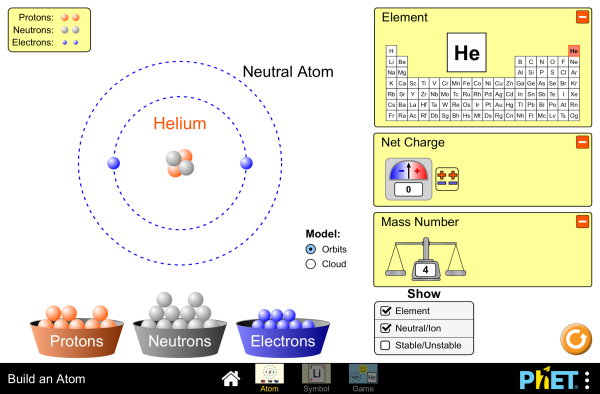
 atomo (link)
atomo (link)

....e questo non è un atomo:...
....

....
...
 la legge dell'inverso del quadrato (link)
la legge dell'inverso del quadrato (link)
- - -
il campo elettrico:
 VIDEO tra Newton e Maxwell, documentario: la storia di Michael Faraday
VIDEO tra Newton e Maxwell, documentario: la storia di Michael Faraday
 simulazione di un campo elettrico:
simulazione di un campo elettrico:
 cariche e campo elettrico:
cariche e campo elettrico:
 l'hockey nel campo elettrico:
l'hockey nel campo elettrico:
- - -
- - -

LINEE DI CAMPO o linee di forza di un campo vettoriale:
1) sono più fitte dove il campo è più intenso
(criterio di Faraday, indicano il modulo del vettore campo in quel punto)
2) sono linee orientate la cui tangente è diretta come il campo in quel punto
(indicano direzione e verso)
3) non si intersecano mai (altrimenti non sarebbe unica la retta tangente)
- nel caso del campo gravitazionale sono dirette verso il centro di massa
- nel caso del campo elettrico sono dirette dalla cariche positive verso quelle negative
- nel caso del campo magnetico sono dirette dal polo nord verso il polo sud
- - -
- - -
Il Teorema di GAUSS per il campo elettrico
una premessa: il problema del piccolo Gauss sulla somma dei numeri da 1 a 100
- - -
 visualizzazione del vettore area: https://www.geogebra.org/m/GtgBUcGN (geogebra link)
visualizzazione del vettore area: https://www.geogebra.org/m/GtgBUcGN (geogebra link)
 flusso del campo elettrico: https://www.geogebra.org/m/pYR2t8FN (geogebra link)
flusso del campo elettrico: https://www.geogebra.org/m/pYR2t8FN (geogebra link)
Il Teorema di Gauss per il campo elettrico:
- - -
1. una applicazione del teorema di Gauss:

- - -
2. una applicazione del teorema di Gauss: 
 Soluzione Esercizio n.55 pag.653 (pdf)
Soluzione Esercizio n.55 pag.653 (pdf)
- - -
3. Una applicazione del Teorema di Gauss: determinare il campo elettrico generato da una distribuzione piana di carica (cfr.pag.162-164):
4. Una applicazione del Teorema di Gauss: determinare il campo elettrico generato da un filo uniformemente carico (cfr.pag.164-165):
- - -
 Formulario cap 15: forze elettriche e campi elettrici (pdf)
Formulario cap 15: forze elettriche e campi elettrici (pdf)
- - -

 Esercitazione per preparare la verifica su forze e campi elettrici (pdf)
Esercitazione per preparare la verifica su forze e campi elettrici (pdf)
- - -
↓bottom↓
↑top↑
Cap.17 - IL POTENZIALE ELETTRICO
 Appunti Energia potenziale elettrica e potenziale elettrico (pdf)
Appunti Energia potenziale elettrica e potenziale elettrico (pdf)
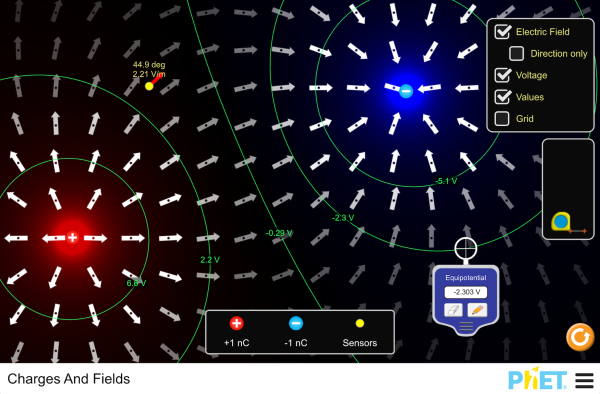
 simulazione di un campo elettrico con misurazione del potenziale elettrico:
simulazione di un campo elettrico con misurazione del potenziale elettrico:
rappresentazione curve di livello in topografia: 
- - -
i CONDENSATORI:



 simulazione di un CONDENSATORE piano intro (link)
simulazione di un CONDENSATORE piano intro (link)
 simulazione "CAPACITOR LAB" (link)
simulazione "CAPACITOR LAB" (link)
- - -

 Esercitazione per preparare la VERIFICA su Energia potenziale elettrica e potenziale elettrico (pdf)
Esercitazione per preparare la VERIFICA su Energia potenziale elettrica e potenziale elettrico (pdf)
Soluzioni (pdf)
- - -
- - -
↓bottom↓
↑top↑