3B Liceo Scientifico - FISICA a.s. 2021-2022
↓bottom↓
"Una legge fisica è una regolarità della natura esprimibile in forma matematica" (Richard Feynman, USA 1918-1988)
 profili GeoGebra 3B (link)
profili GeoGebra 3B (link)

 elenco di possibili domande di teoria (pdf)
elenco di possibili domande di teoria (pdf) 
 programma svolto di fisica (pdf)
programma svolto di fisica (pdf)
GOOGLE CLASSROOM: codice corso 3B FISICA: qg3vfnt
(utilizzare le credenziali di Google Suite già fornite dal liceo - tutorial come iscriversi)
 la stella nascosta di Samuel Loyd (pdf)
la stella nascosta di Samuel Loyd (pdf)
 rappresentazione cronologica dell' ECUMENE (link)
rappresentazione cronologica dell' ECUMENE (link)
 Calcolatrici ammesse esame di stato (nota MIUR - circolare 105)
Calcolatrici ammesse esame di stato (nota MIUR - circolare 105)
↓bottom↓
↑top↑
CAP.10 LAVORO ed ENERGIA
 FORMULARIO LAVORO ed ENERGIA (pdf)
FORMULARIO LAVORO ed ENERGIA (pdf)
 prodotto scalare e coseno di un angolo (pdf, per ora solo la parte sul Teorema di Pitagora)
prodotto scalare e coseno di un angolo (pdf, per ora solo la parte sul Teorema di Pitagora)
- - -
Teorema dell'energia cinetica:
" la variazione di energia cinetica ΔK di un corpo è uguale al lavoro L della forza totale che ha agito su di esso:"
ΔK=L
- - -
il lavoro di una forza è numericamente uguale all'area della porzione di piano che si trova sotto al grafico della forza compresa tra i punti iniziale e finale dello spostamento:
- - -
calcola il lavoro totale
- - -
 la CONSERVAZIONE dell'energia meccanica con lo skateboard (simulazione PhET)
la CONSERVAZIONE dell'energia meccanica con lo skateboard (simulazione PhET)
- - -
 la CONSERVAZIONE dell'energia meccanica con le molle (simulazione PhET)
la CONSERVAZIONE dell'energia meccanica con le molle (simulazione PhET)
- - -
una forza si dice CONSERVATIVA
quando il lavoro che essa compie su un corpo che si sposta dal punto inziale A al punto finale B
non dipende dalla traiettoria percorsa ma solo dalla posizione dei punti iniziale A e finale B
differenza tra forze conservative e forze non conservative (PWW):
- - -
ENERGIA POTENZIALE
Energia Potenziale U di un sistema (può essere associata solo ad una forza conservativa):
dopo aver scelto un arbitrario stato zero in cui l’energia potenziale è posta nulla, UP=-LO->P
variazione di energia potenziale: ΔU=UB-UA=-LA->B
- - -
- la FORZA PESO è una forza conservativa (in assenza di attriti rilevanti)
 Piano inclinato - la Scomposizione del vettore P (GeoGebra)
Piano inclinato - la Scomposizione del vettore P (GeoGebra)
 Scheda di lavoro con GeoGebra sul piano inclinato (pdf)
Scheda di lavoro con GeoGebra sul piano inclinato (pdf)
il Lavoro di una forza conservativa lungo un percorso chiuso è nullo
conseguenza: il lavoro che una forza conservativa compie in un percorso da A verso B
è l'opposto del lavoro che tale forza compie da B verso A
energia potenziale gravitazionale: U=mgh
- - -
- la FORZA ELASTICA è una forza conservativa
- - -
nergia potenziale elastica: 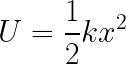
- - -
- - -
in un sistema isolato in cui agiscono solo forse conservative l'energia meccanica totale si conserva
Emeccanica totale = K + U = costante
- - -
La variazione di energia meccanica di un sistema isolato è uguale al lavoro compiuto dalle forze non conservative
ΔE = Efinale-Einiziale = Lnon conservative
- - -
PRINCIPIO di CONSERVAZIONE dell'ENERGIA: "In un sistema isolato, l'energia totale si conserva"
- - -
La potenza P definita come il rapporto fra il lavoro compiuto e l'intervallo di tempo Δt per compierlo
La potenza istantanea erogata da una forza F ad un corpo in moto con velocità v vale:
- - -
 la PRIMA RIVOLUZIONE IDUSTRIALE (link)
la PRIMA RIVOLUZIONE IDUSTRIALE (link)
- - -

 ZANICHELLI TEST allenamento sul LAVORO ed ENERGIA (link)
ZANICHELLI TEST allenamento sul LAVORO ed ENERGIA (link)
- - -

 Esercitazione sul LAVORO ed ENERGIA - soluzioni (pdf)
Esercitazione sul LAVORO ed ENERGIA - soluzioni (pdf) 
- - -
↓bottom↓
↑top↑
CAP.1 SISTEMI di riferimento INERZIALI e non INERZIALI
1° PRINCIPIO o principio di inerzia
l'esperimento di Galileo Galilei (Pisa, 1564-1642): --> leggi a pag.98 (testo evidenziato sul principio di inerzia) --> leggi a pag.88 (esperimento della nave a pag.89 esperimento del cavallo) --> leggi a pag.36-37 (sulla caduta dei gravi)
- - -
|
.tif.jpg) |
i principi della dinamica RIPASSO e RICHIAMI:
“Nello studio della fisica, il principio d’inerzia e il concetto di forza sono stati, storicamente, due degli scogli più duri per gli studenti[…]. Non è sorprendente che il problema didattico in questo campo sia così difficile da risolvere, se si tiene conto di quanto tempo fu necessario all ’inizio alla mente umana per chiarire questi aspetti dei fenomeni naturali. Coloro che affrontano tale studio per la prima volta devono sempre esaminare di nuovo almeno alcuni degli ostacoli e delle difficoltà originali.” [Arons, 1992]1° PRINCIPIO o principio di inerzia:
"Un corpo rimane nel suo stato di quiete o di moto rettilineo uniforme, finché non interviene una causa esterna a variare il suo stato"
principio di relatività Galileiano: "le leggi della meccanica sono le stesse in tutti i sistemi di riferimento inerziali"
oppure: "non è possibile distinguere con esperimenti meccanici due sistemi inerziali in M.R.U. l'uno rispetto all'altro"
2° PRINCIPIO o principio fondamentale della dinamica:
In un sistema inerziale, una Forza che agisce su un corpo di massa m ne provoca una accelerazione a tale che:

- - -
3° PRINCIPIO o principio di azione e reazione:
"quando due corpi interagiscono la forza che il primo esercita sul secondo ha stesso modulo, stessa direzione e verso opposto a quella che il secondo corpo esercita sul primo"
osservazione 1: non esistono forze singole, ma coppie di forze
osservazione 2: è arbitrario stabilire quale sia la azione e quale la reazione
osservazione 3: l'azione e la reazione sono forze che agiscono su corpi diversi
- - -
sistemi NON inerziali e forze apparenti
"si chiama forza apparente, una forza che non è prodotta da una interazione fisica, ma che si osserva in un sistema di riferimento NON inerziale a causa della accelerazione del sistema stesso" (pag.129)
si potrebbe dire che le forze apparenti sono forze che "appaiono" solo se mi trovo in un sistema di riferimento NON inerziale
- - -
di seguito consideriamo le seguenti forze "apparenti"
- peso "apparente" 
- forza centrifuga 
- forza di Coriolis 
 la forza di Coriolis nel film "fuga dall'inferno" del 2013
la forza di Coriolis nel film "fuga dall'inferno" del 2013
 G.B. Guglielmini e la dimostrazione della rotazione terrestre (1790) -
G.B. Guglielmini e la dimostrazione della rotazione terrestre (1790) -  n.34 pag.144 (pdf)
n.34 pag.144 (pdf)
- - -
I Moti della Terra secondo Copernico (1543) (cfr. capitolo XI)
 I Moti della Terra (Planetario di Padova - 1'23")
I Moti della Terra (Planetario di Padova - 1'23")
- - -
la prima prova della rotazione terrestre 1851:
 il pendolo di Focault (1851)
il pendolo di Focault (1851)
 modello di pendolo di Focault UniPadova
modello di pendolo di Focault UniPadova
 oscillazioni del pendolo di Focault UniPadova
oscillazioni del pendolo di Focault UniPadova
 il pendolo di focault (Superquark)
il pendolo di focault (Superquark)
 il Pendolo di Foucault a Valencia
il Pendolo di Foucault a Valencia
 animazione e visualizazione della forza di Coriolis e della forza Centrifuga
animazione e visualizazione della forza di Coriolis e della forza Centrifuga
 riferimenti filosofici: il pendolo di Schopenhauer (link)
riferimenti filosofici: il pendolo di Schopenhauer (link)
- - -
 MALMOE, giallo sulla bilancia (PDF La Gazzetta dello Sport 24/08/2005)
MALMOE, giallo sulla bilancia (PDF La Gazzetta dello Sport 24/08/2005)
- - -
↓bottom↓
↑top↑
CAP.2 IMPULSO e Quantità di Moto
 Le sfere di Newton's #1 (di Christiaan Huygens, Royal Society nel 1662)
Le sfere di Newton's #1 (di Christiaan Huygens, Royal Society nel 1662)
 Le sfere di Newton's #2 (di Christiaan Huygens, Royal Society nel 1662)
Le sfere di Newton's #2 (di Christiaan Huygens, Royal Society nel 1662)
- - -
il moto del CENTRO di MASSA
- - -
il PENDOLO BALISTICO (esempio 8 pag.161)
 VideoEsperimento sul PENDOLO BALISTICO (thanks to GiLi)
VideoEsperimento sul PENDOLO BALISTICO (thanks to GiLi)
- - -
 FORMULARIO Impulso, quantità di moto e urti (pdf)
FORMULARIO Impulso, quantità di moto e urti (pdf) 
- - -
 TEST1: Esercitazione sulle unità di misura della dinamica (link)
TEST1: Esercitazione sulle unità di misura della dinamica (link) 

 Esercitazione Sistemi di Riferimento non inerziali, Quantità di moto e impulso (Cap.1 e 2) - soluzioni (pdf)
Esercitazione Sistemi di Riferimento non inerziali, Quantità di moto e impulso (Cap.1 e 2) - soluzioni (pdf) 
- - -
↓bottom↓
↑top↑
CAP.3 Cinematica e Dinamica Rotazionale
la "rigatura" di un cannone da campo M18 da 80mm dell'esercito austriaco della 1° Guerra Mondiale
(museo della guerra di Vienna - Heeresgeschichtliches Museum  )
)



La conservazione del momento angolare:
 La conservazione del momento angolare
La conservazione del momento angolare
- - -
 ROLLING CYLINDER (link thingiverse)
ROLLING CYLINDER (link thingiverse)
 Rolling Cylinder (link youtube)
Rolling Cylinder (link youtube)
 il nostro esperimento in classe (link youtube)
il nostro esperimento in classe (link youtube)
- - -
Rolling Cylinder:
- - -
Fidget spinner:
- - -
Who will win the race?

Bet on blue or green or brown or red and clic to start the race...
- - -

 ZANICHELLI TEST allenamento La dinamica dei corpi in rotazione (link)
ZANICHELLI TEST allenamento La dinamica dei corpi in rotazione (link)
- - -
↓bottom↓
↑top↑
CAP.4 la GRAVITAZIONE
«È opinione comune che la terra stia ferma; ma Filolao Pitagorico dice che gira intorno al fuoco secondo un circolo obliquo, così come il sole e la luna. Eraclide Pontico ed Ecfanto Pitagorico fanno muovere la terra, non però di moto traslatorio, ma rotatorio, infilata in un asse a guida di ruota e girante intorno al proprio centro da occidente a oriente PLUTARCO, De placitis philosophorum, III, cap. 1,3 (I sec.D.C.)
lo studio del cielo nell'età classica:
«E doveva pensare [Timeo] che la Terra non fosse immobile attaccata all’asse del mondo, ma facesse piuttosto un’intera rivoluzione attorno a questo come affermarono Aristarco e Seleuco: l’uno «assumendolo come ipotesi», l’altro «dimostrandolo ». Del resto anche Teofrasto racconta che Platone in tarda età si pentì d’aver posto la Terra al centro del cosmo, non essendo affatto convinto di questa collocazione»;
Platonicae quaestiones , VIII, I; Moralia, 1006C; Plutarco 2006 »
il sistema GeoCentrico o TOLEMAICO - il sitema ElioCentrico o COPERNICANO:
ALMAGESTO - De RIVOLUTIONIBUS ORBIUM PLANETORUM LIBRI SEX
 1. ARISTARCO di SAMOS (Gr, 310 a.C. - 230 a.C.)
1. ARISTARCO di SAMOS (Gr, 310 a.C. - 230 a.C.)
un omaggio ad Aristarco di Samos:prima ipotesi di sistema eliocentrico; prime stime distanza terra-luna e terra-sole. La sua ipotesi rimase minoritaria per secoli non potendo spiegare:
1. l'elevata velocità della Terra se questa ruotasse attorno al proprio asse e se rivoluzionasse attorno al Sole (il principio d'inerzia sarà formulato da Galileo nel 1632)
2. il problema della caduta verticale dei gravi (il principio d'inerzia sarà formulato da Galileo nel 1632)
3. l'assenza di vento durante il moto della Terra e quindi l'esistenza del vuoto (di cui ne sarà dimostrata l'esistenza intorno al 1650)
4. l'assenza di parallasse nelle stelle che dovrebbe essere visibile se la Terra rivoluzionasse attorno al Sole (nemmeno il grande quadrante di Tycho la rilevò, la prima misurazione di parallasse stellare fu nel 1838)
- - -
Altro problema da affrontare è come spiegare il moto retrogrado dei pianeti
il moto retrogrado di Marte a marzo 2003:

il moto retrogrado di Giove e di Saturno danno luogo ad una straordinaria tripla congiunzione nell'anno -6,
vicino al punto vernale nella costallazione dei pesci (in 26 secondi sono rappresentati 9 mesi di osservazioni):
ecco come il modello GeoCentrico e quello Eliocentrico forniscono una spiegazione di questo fenomeno:



 Moto Retrogrado secondo il modello GeoCentrico
Moto Retrogrado secondo il modello GeoCentrico
 Moto Retrogrado secondo il modello ElioCentrico
Moto Retrogrado secondo il modello ElioCentrico
 TUTORIAL: Moto Retrogrado secondo il modello ElioCentrico (thanks to Fi.Va.)
TUTORIAL: Moto Retrogrado secondo il modello ElioCentrico (thanks to Fi.Va.)
- - -
lo studio del cielo prima del cannocchiale:
L'astronomia non nasce col telescopio, nasce con la matematica...
 2. COPERNICO (Pl, 1473-1543) e il problema del calendario
2. COPERNICO (Pl, 1473-1543) e il problema del calendario
- - -
 3. TYCHO BRAHE (Dk, 1546-1601), l'astrologo
3. TYCHO BRAHE (Dk, 1546-1601), l'astrologo
- - -
 4. KEPLERO (De, 1571-1631), l'ultimo astronomo ad occhio nudo
4. KEPLERO (De, 1571-1631), l'ultimo astronomo ad occhio nudo
Lo studio del cielo con il canna-occhiale:
 5. GALILEO GALILEI (Pisa, 1564-1642) e la reinvenzione del canna-occhiale
5. GALILEO GALILEI (Pisa, 1564-1642) e la reinvenzione del canna-occhiale
il Sistema Solare in estrema sintesi:
- - -
 Isaac NEWTON e la legge di gravitazione universale
Isaac NEWTON e la legge di gravitazione universale
- - -
 la conquista dello spazio, tappe principali (link)
la conquista dello spazio, tappe principali (link)
 Assenza apparente di peso
Assenza apparente di peso
 Assenza apparente di peso: la caduta libera di un ascensore (GeoPop)
Assenza apparente di peso: la caduta libera di un ascensore (GeoPop)
 approfondimento: Galleggiare nello spazio (INFN scienza x tutti)
approfondimento: Galleggiare nello spazio (INFN scienza x tutti)
- - -
 Satelliti geostazionari
Satelliti geostazionari
 ESRI satellite map (link)
ESRI satellite map (link)
- - -
 La Velocità di fuga
La Velocità di fuga
- - -
 Tabella dati Sistema Solare per esercitazione (pdf)
Tabella dati Sistema Solare per esercitazione (pdf)

 ESERCITAZIONE sulla gravitazione (pdf)
ESERCITAZIONE sulla gravitazione (pdf)
- - -

 ZANICHELLI TEST allenamento sulla legge di gravitazione universale (link)
ZANICHELLI TEST allenamento sulla legge di gravitazione universale (link)
 Altri problemi di fine capitolo sulla gravitazione (pdf)
Altri problemi di fine capitolo sulla gravitazione (pdf)
- - -
↓bottom↓
↑top↑
La LEGGE dei GAS PERFETTI (cap.6)
prima di cominciare la termodinamica.....
 formulario di termologia (pdf)
formulario di termologia (pdf)
“Quando si tratta di atomi, il linguaggio può essere usato solo come si fa nelle poesie” Niels Bohr
"nella scienza si cerca di dire alla gente, in modo da essere capiti da tutti, qualcosa che nessuno sapeva prima. Invece nella poesia accade esattamente il contrario" Paul Dirac
 La tavola periodica degli elementi di MENDELEEV (link)
La tavola periodica degli elementi di MENDELEEV (link)
 Costruisci un atomo (link PHET Colorado)
Costruisci un atomo (link PHET Colorado)
...., ma questo non è un atomo... e questa....

René Magritte, il tradimento delle immagini (1929)

 Cronologia 1: Atomi e molecole (pdf)
Cronologia 1: Atomi e molecole (pdf)
 il numero di AVOGADRO: appunti essenziali (pdf)
il numero di AVOGADRO: appunti essenziali (pdf)
 quante "molecole" ci sono in un litro d'acqua? (link)
quante "molecole" ci sono in un litro d'acqua? (link)
- - -
 William Thomson, LORD KELVIN e la temperatura assoluta (link)
William Thomson, LORD KELVIN e la temperatura assoluta (link)
 un esercizio interattivo sulla temperatura KELVIN (link)
un esercizio interattivo sulla temperatura KELVIN (link)
- - -
le variabili di stato di un sistema termodinamico:
T [K] (altre unità di misura della temperatura)
P [pa]=[N/m2] (altre unità di misura della pressione)
V [m3] (1m3=1000 litri)
un esempio di metro cubo di acqua:

equazione di stato di un gas perfetto: PV=nRT
 la legge dei gas perfetti sul piano di CLAPEYRON (link)
la legge dei gas perfetti sul piano di CLAPEYRON (link)
 un esercizio sulla legge dei gas perfetti (pdf)
un esercizio sulla legge dei gas perfetti (pdf)
 un esercizio interattivo sulla legge dei gas perfetti (link)
un esercizio interattivo sulla legge dei gas perfetti (link)
- - - - - - - - - -
- ogni stato di equilibrio è rappresentato da un punto nel diagramma P-V (per una data quantità di moli, nel diagramma 2 moli)
 un esercizio interattivo sul piano PV (link)
un esercizio interattivo sul piano PV (link)
- - - - -
LAVORO e le principali trasformazioni termodinamiche:
un trasformazione è detta quasi-statica quando avviene attraverso una successione di stati di equilibrio solo per quantità infinitesime
(una trasformazione quasi-statica è rappresentata da una curva continua nel diagramma p-V)
| traformazione ISOBARA (=a pressione costante) |
 |
| traformazione ISOCORA (=a volume costante) |
 |
| traformazione ISOTERMA (=a temperatura costante) |
 |
- - - - - - - - - -
 la TEORIA CINETICA DEI GAS
la TEORIA CINETICA DEI GAS
- - -
Il CALORE (cap.10)
 la teoria del calorico (pdf)
la teoria del calorico (pdf)
- - - - - - - - - -
 Benjamin Thompson conte RUMFORD (USA,1753-1814)
Benjamin Thompson conte RUMFORD (USA,1753-1814)
"Mi sembra estremamente difficile, se non del tutto impossibile, farmi una idea chiara di una qualsiasi cosa capace di essere suscitata e trasmessa nel modo in cui il calore è suscitato e trasmesso in questi esperimenti che sia diversa dal MOVIMENTO" Benjamin Thompson, conte Rumford
- - - - - - - - - -
 James Joule (UK,1818-1889)
James Joule (UK,1818-1889)
 Calore specifico dell'acqua: c = 4186 J/(K·kg)
Calore specifico dell'acqua: c = 4186 J/(K·kg)
 Tabella di calori specifici (link)
Tabella di calori specifici (link)
 un esercizio sul mulinello di Joule (link)
un esercizio sul mulinello di Joule (link)
 un esercizio sulla cascata di Joule (link)
un esercizio sulla cascata di Joule (link)
- - - - - - - - - -
 un esercizio sulla capacità termica (link)
un esercizio sulla capacità termica (link)
- - - - - - - - - -
 PASTA SENZA FUOCO (1) - Perché continuare a far bollire l'acqua è inutile (04.09.2017)
PASTA SENZA FUOCO (1) - Perché continuare a far bollire l'acqua è inutile (04.09.2017)
- - - - - - - - - -
 Tabella dati calore specifico e calore latente per esercitazione (pdf)
Tabella dati calore specifico e calore latente per esercitazione (pdf)

 ESERCITAZIONE Termodinamica 1 (pdf) - Soluzioni (pdf)
ESERCITAZIONE Termodinamica 1 (pdf) - Soluzioni (pdf)
- - -
↓bottom↓
↑top↑
il PRIMO PRINCIPIO della TERMODINAMICA (cap.7)
 Lorenzo Baglioni - I Principi della Termodinamica feat. I Supplenti Italiani
Lorenzo Baglioni - I Principi della Termodinamica feat. I Supplenti Italiani
- la TERMODINAMICA ha come oggetto la descrizione macroscopica dell'interazione fra corpi che possono scambiare energia per effetto dell'azione di forze (lavoro) o in conseguenza di differenze di temperature (calore)
- un sistema è in uno stato di equilibrio termodinamico quando le sue variabili termodinamiche rimangono costanti nel tempo
Principio zero della termodinamica: "Se due sistemi sono individualmente in equilibrio termico con un terzo sistema, essi sono in equilibrio termico tra di loro"
- - -
il CALORE Q è l'energia scambiata tra due corpi unicamente a causa della differenza di temperatura esistente tra essi
l'ENERGIA INTERNA U di un corpo è la somma tra le energie cinetiche e potenziali delle sue molecole
U è una funzione di stato come T, P, e V
U=3/2·
n·R·T (per un gas perfetto monoatomico)
U si misura in J
- - -
PRIMO PRINCIPIO della TERMODINAMICA:
"la variazione di energia interna di un sitema è pari alla differenza tra CALORE ASSORBITO e LAVORO COMPIUTO dal sistema"
ΔU=Q-L
N.B.: è considerato positivo il CALORE assorbito dal sistema
è considerato positivo il LAVORO compiuto dal sistema
il segno del lavoro L in termodinamica:

il segno del lavoro L e del calore Q in termodinamica:

- - -
LAVORO e le principali trasformazioni termodinamiche:
 Scheda di lavoro: il lavoro e le principali trasformazioni Termodinamiche (pdf)
Scheda di lavoro: il lavoro e le principali trasformazioni Termodinamiche (pdf) 
un trasformazione è detta quasi-statica quando avviene attraverso una successione di stati di equilibrio solo per quantità infinitesime
(una trasformazione quasi-statica è rappresentata da una curva continua nel diagramma p-V)
| traformazione ISOBARA (=a pressione costante) |
 |
| traformazione ISOCORA (=a volume costante) |
 |
| traformazione ISOTERMA (=a temperatura costante) |
 |
| traformazione ADIABATICA (=senza scambi di calore con l'esterno) |
 |
| traformazione CICLICA (=inizia e finisce nello stesso stato, nel diagramma è rappresentato da una curva chiusa) |
 |
 il LAVORO nelle trasformazioni ISOTERME
il LAVORO nelle trasformazioni ISOTERME
- - -
↓bottom↓
↑top↑
il SECONDO PRINCIPIO della TERMODINAMICA (cap.8)
“La lotta generale per l'esistenza degli esseri viventi non è una lotta per l'energia, ma è una lotta per l'entropia.” Ludwig Boltzmann
la MERIDIANA nel chiostro del convento di SAN BERNARDINO a TRENTO
- - -
il SECONDO PRINCIPIO della TERMODINAMICA (cap.8)
PREMESSA 1: NON SI PUO' SCONFIGGERE il SECONDO PRINCIPIO della TERMODINAMICA, si può perdere o al più pareggiare!
PREMESSA 2: SE L'ENERGIA SI CONSERVA (PRIMO PRINCIPIO DELLA TERMODINAMICA) DOVE SAREBBE IL "PROBLEMA ENERGETICO"?
PREMESSA 3:"ENERGIA" dal greco: "capacità di agire". Tradotto in fisica: "capacità di compiere LAVORO"
 la CONSERVAZIONE dell'energia meccanica con lo skateboard (simulazione PhET)
la CONSERVAZIONE dell'energia meccanica con lo skateboard (simulazione PhET)
PREMESSA 4 :  la PRIMA RIVOLUZIONE IDUSTRIALE (link)
la PRIMA RIVOLUZIONE IDUSTRIALE (link)
- - -
DEFINIZIONI:
- TERMODINAMICA: studio delle trasformazini di energia nelle sue varie forme
- SISTEMA: quantità di materia separata da ciò che la circonda
- AMBIENTE: tutto ciò che è esterno al sistema
- una MACCHINA TERMICA è un dispositivo che trasforma l'energia interna dei corpi in lavoro meccanico mediante trasformazioni cicliche di un sistema termodinamico
- il RENDIMENTO di una macchina termica è il rapporto tra lavoro compiuto L e calore assorbito QC misurati durante un ciclo

enunciato del secondo principio della Termodinamica:
 |
 Enunciato di Lord KELVIN (William Thomson, UK, 1824-1907): Enunciato di Lord KELVIN (William Thomson, UK, 1824-1907):
“È IMPOSSIBILE realizzare una trasformazione il cui unico risultato sia quello di convertire in lavoro del calore sottratto a un'unica sorgente a temperatura uniforme”(ad es. dal mare)
|
 |
enunciato di CLAUSIUS (Rudolf CLAUSIUS, DE, 1822-1888)
“È IMPOSSIBILE realizzare una trasformazione il cui unico risultato sia il passaggio di calore da un corpo più freddo a uno più caldo senza l’apporto di lavoro esterno” |
| si potrebbe equivalentemente enunciare: "in un sitema energeticamente isolato tutte le differenze di temperatura tendono ad annullarsi spontaneamente" | |
oppure: "in un sitema energeticamente isolato a temperatura uniforme non si possono spontaneamente creare differenze di potenziale termico tra diverse regioni" di conseguenza è necessario consumare energia per raffredare un ambiente come l'interno di un frigorifero o l'interno di una stanza con un climatizzatore |
|
conseguenze del secondo principio della Termodinamica: 1. È IMPOSSIBILE far passare calore da un corpo più freddo a uno più caldo senza compiere lavoro 2. È IMPOSSIBILE trasformare tutto il calore in lavoro 3. È IMPOSSIBILE costruire una macchina termica con rendimento η=1
infatti la macchina deve necessariamente operare tra due termostati a uno dei quali cedere il calore Qf che non può essere nullo (in queste notazioni f sta per freddo e c sta per caldo) di fatto le macchine termiche reali difficilmente raggiungono rendimenti superiori al 50%, è necessario quindi individuare le condizioni che assicurano il maggior rendimento possibile, per far questo si definisce: una trasformazione è detta reversibile se, a partire dallo stato finale, è possibile riportare sia il sistema sia l'ambiente con cui interagisce ai rispettivi stati iniziali in generale una trasformazione è reversibile se: N.B. le trasformazioni reali sono tutte irreversibili (ad esempio...)
|
|
|
TEOREMA di CARNOT: (Sadi Carnot, Fr, 1796-1832)
“tutte le macchine termiche REVERSIBILI, operanti tra le temperature Tc e Tf, hanno lo stesso rendimento ηrev e nessuna macchina reale (=irreversibile), operante fra le stesse temperature può avere un rendimento ηirrev maggiore:”ηrev ≥ ηirrev
conseguenze del teorema di Carnot: Il rendimento di una macchina di Carnot (detta anche macchina ideale o macchina reversibile) che opera tra le temperature Tc e Tf è dato da (dove le temperature sono espresse in gradi Kelvin):
|
4. È IMPOSSIBILE raggiungere lo ZERO ASSOLUTO mediante un numero finito di trasformazioni termodinamiche (è anche detto Terzo principio della Termodinamica)Infatti se, PER ASSURDO, una macchina termica potesse operare tra una sorgente TC e Tf=0K si potrebbe avere una macchina con rendimento pari ad 1
|
|
5. È IMPOSSIBILE realizzare il moto perpetuo infatti il moto perpetuo di prima specie è in aperta violazione del primo principio della Termodinamica
3D Printed Da Vinci's Perpetual Motion Machine
|
|
l'ENTROPIAavendo osservato che: nel 1865 Rudolf CLAUSIUS ritenne di introdurre una nuova FUNZIONE di STATO: l'ENTROPIA "ENTROPIA" dal greco: "TRASFORMAZIONE INTERNA" scrive Clausius: “ho voluto intenzionalmente adottare il termine entropia per rimanere il più vicino possibile alla parola energia, in quanto le due grandezze … sono così affini in senso fisico che anche nella definizione questo accostamento pare opportuno” secondo Clausius il comportamento asimmetrico del calore rappresentava due diversi tipi di cambiamento: uno era un cambiamento di temperatura (energia termica che passava dal caldo al freddo), l’altro era un cambiamento di energia (energia meccanica che si trasformava in energia termica per attrito) e concluse che queste variazioni erano due aspetti dello stesso fenomeno: variazioni di ENTROPIA. Dunque per le applicazioni è necessario calcolare le variazioni di ENTROPIA di un sistema, (l’entropia non è misurabile direttamente) così definite: 
[l'ENTROPIA si misura in J/K] Da questa definizione l’ENTROPIA dipende non solo dagli scambi di energia, ma anche dalla Temperatura.
Clausius sosteneva che tutte le variazioni di carattere naturale (variazioni di energia e temperatura che si verificano spontaneamente in natura come ad esempio il fluire di calore dal corpo più caldo al più freddo o la trasformazione di energia in calore per attrito) sarebbero state considerate variazioni positive (=entropia in aumento); mentre tutte le variazioni innaturali (tutte le variazioni di energia e temperatura che si verificano quando la natura è sollecitata da una macchina) sarebbero state considerate variazioni entropiche negative. Egli giunse alla conclusione che tutti gli scambi di entropia positiva e negativa che si verificano nella totalità delle macchine esistenti nell’universo avevano sempre l’effetto di aumentare l’entropia. Il nostro universo è popolato da macchine imperfette, fossero queste animate e minuscole come le cellule del corpo umano o inanimate e gigantesche come le galassie. Nel nostro universo l’energia totale si conserva, ma l’ENTROPIA PUÒ SOLO AUMENTARE o al più restare invariata
dunque tutto l’universo invecchierà e morirà una volta che tutti i suoi fenomeni naturali irreversibili si saranno completamente esauriti, quando cioè non ci saranno più due sorgenti di calore a temperature differenti, ma tutto l’universo si troverà alla stessa temperatura e le trasformazioni spontanee non saranno più possibili (cfr.enunciato di KELVIN) - Il 2° principio diventa dunque una formulazione del principio di NON conservazione dell’ENTROPIA la degradazione dell'energia, o l'aumento di Entropia, è una conseguenza statisticamente prevedibile dei movimenti e delle collisioni che avvengono a caso tra le molecole. Si considerino ad esempio due contenitori di un gas isolati a diversa temperatura, quando verranno messi a contatto le molecole calde (le più veloci) e le molecole fredde (meno veloci) passeranno a caso da un ambiente all'altro (o meglio scambieranno a caso le loro energie cinetiche durante gli urti in modalità simili a quelle descritte nel moto Browniano) e con il passare del tempo ciò renderà nulla la differenza di temperatura iniziale tra i due scomparti. L'aumento di Entropia che ne consegue è legato ad un aumento di disordine: le molecole veloci e quelle lente inizialmente separate si mescoleranno e l'energia totale del sistema si ripartirà statisticamente in conseguenza delle collisioni che si verificheranno e i due scomparti inizialmente distinguibile per la temperatura diventeranno equivalenti. Prima del mescolamento il sistema avrebbe potuto compiere un lavoro in virtù della differenza di temperatura tra i due scomparti, ma una volta raggiunto l'equilibrio termico nessun lavoro potrà più prodursi.
6. È IMPOSSIBILE diminuire l'ENTROPIA di un sistema isolato (senza compiere lavoro dall'esterno) 
in un sistema isolato, lo stato di entropia massima è lo stato di equilibrio stabile |
|
|
Boltzmann (Ludwig, AU, 1844-1906) suggerì che l’entropia possa anche essere letta come misura del disordine di un sistema e stabilì che: “L’Entropia di uno stato macroscopico è proporzionale alla probabilità termodinamica di quello stato:”
l'irreversibilità di una trasformazione termodinamica è connessa all'aumento di entropia del sistema, come anche l'irreversibilità dei processi naturali è legata all'aumento del disordine che qualunque sistema manifesta durante la sua evoluzione. Osservando l'immagine seguente nessuno si aspetta che la disposizione ordinata per colore delle biglie sia stata ottenuta scuotendo la scatola a partire dalla disposizione disordinata
approfondimento: il "diavoletto" di Maxwell
|
| 7. È IMPOSSIBILE tornare indietro nel tempo
Tutte queste scoperte significavano per Clausius, che l’universo, essendo un sistema isolato, stava diventando più caotico e che quindi, tempo prima, dovesse essere stato molto più ordinato, insomma come se Qualcosa o Qualcuno avesse costruito un meccanismo e lo avesse caricato come un orologio a molla che ora pian piano stava perdendo la sua carica ed era destinato a fermarsi...
8. È IMPOSSIBILE che l'universo esista da infinito tempo CLAUSIUS osservò inoltre che: “l’energia dell’universo è costante (l’intero universo può essere considerato un sistema isolato e l’energia in esso contenuta è da sempre la stessa, in accordo con il primo pincipio), ma l’entropia è in aumento” (quindi gli scambi di energia, da cui dipende la vita, non saranno possibili per sempre e dato che la vita esiste tuttora si può concludere che l’universo non esiste da infinito tempo…) |
|
| 9. ............................ | |
| 10. ........................... |
«La legge secondo cui l'entropia aumenta ha sempre, credo, la posizione suprema tra le leggi della natura. Se qualcuno ti fa notare che la tua teoria dell'universo da compagnia è in disaccordo con le equazioni di Maxwell, allora tanto peggio per le equazioni di Maxwell. Se si scopre che è contraddetto dall'osservazione, beh, questi sperimentatori a volte fanno cose confuse. Ma se la tua teoria è contraria alla Seconda Legge della Termodinamica, non posso darti alcuna speranza; non resta che crollare nella più profonda umiliazione» Sir Arthur Eddington (UK, 1882-1944)
- - -

 ZANICHELLI TEST allenamento sul primo principio della termodinamica (link)
ZANICHELLI TEST allenamento sul primo principio della termodinamica (link)

 ZANICHELLI TEST allenamento sul secondo principio della termodinamica (link)
ZANICHELLI TEST allenamento sul secondo principio della termodinamica (link)
- - -

 ESERCITAZIONE Termodinamica 2: i principi della termodinamica (pdf) - Soluzioni (pdf)
ESERCITAZIONE Termodinamica 2: i principi della termodinamica (pdf) - Soluzioni (pdf)
- - -
↓bottom↓
↑top↑
- - -
↑top↑










 MEMEX:
MEMEX: 






.jpg)











