↓bottom↓
la TEORIA CINETICA DEI GAS
«Se in qualche cataclisma andassero perdute tutte le conoscenze scientifiche, e una sola frase potesse essere tramandata alle generazioni successive, quale enunciato conterrebbe la maggiore informazione possibile nel minor numero di parole?
Io credo che si tratti dell'ipotesi atomica, seconda la quale tutte le cose sono fatte di [...] piccole particelle in perpetuo movimento che si attraggono a breve distanza, ma si respingono se pressate le une contro le altre. In questa singola frase c'è un'enorme quantità di informazione sul mondo che ci circonda, se soltanto ci si riflette sopra con un po' di immaginazione.»
Richard Feynman (USA, 1918-1988)
le innumerevoli molecole di un gas sono in movimento continuo e casuale e urtano incessantemente l'una contro l'altra e con le pareti del contenitore, il risultato di questi urti è che la velocità di ogni molecola cambia continuamente in funzione della temperatura,
 ...
...
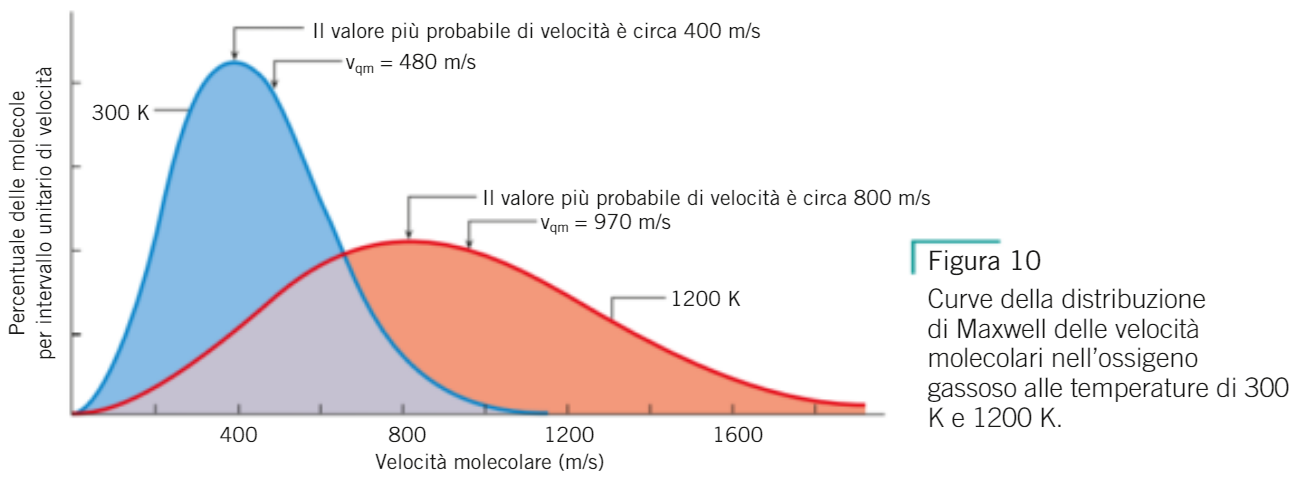
secondo J.C. Maxwell le velocità delle molecole di ossigeno sono così distribuite:
le molecole di un gas non possono essere visualizzate, ma si comportano come le piccole particelle di polline visualizzate per la prima volta dal  botanico Robert Brown e come le particelle di fumo in questo video, tale moto caotico ha preso il nome di moto browniano
botanico Robert Brown e come le particelle di fumo in questo video, tale moto caotico ha preso il nome di moto browniano
 il MOTO BROWNIANO:
il MOTO BROWNIANO:
 il moto browniano con Geogebra (link)
il moto browniano con Geogebra (link)
 Le proprietà dei gas (link PHET)
Le proprietà dei gas (link PHET)
dati essenziali della teoria cinetica dei gas:
1- dimensioni di una molecola di gas: circa 10-10m
2- velocità media delle molecole di un gas: tra circa 400 e 1900 m/s
3- il "libero cammino medio": circa 5,6∙10-8m
4- numero medio di “collisioni” al secondo: circa 8 miliardi
- - - - - - - - - -
approfondimenti
 approfondimento: il moto browniano (INFN scienza x tutti)
approfondimento: il moto browniano (INFN scienza x tutti)
↑top↑